SALT LAKE CITY / AMSTERDAM – Der Hersteller der im Pfizer/BioNTech-Wirkstoff verspritzten Nanopartikel ALC-0159 und ALC-0315, ist bisher nicht in der Lage die zur Zulassung notwendigen Bescheinigungen vorzulegen. Deren Herstellerfirma „Echelon Biosiences“ streicht daraufhin den Hinweis „Dieses Produkt ist nur für Forschungszwecke und nicht für den menschlichen Gebrauch bestimmt“ von seiner Webseite und löst damit weitere Spekulationen aus.
.
Vor etwas über einem Jahr ließ BioNTech/Pfizer die Presse folgende Mitteilung verbreiten:
Nach nur etwas über einem Jahr steht fest, daß diese Äußerung wenig bis gar nichts mit der Realität zu tun haben.
Sei es die VAERS-Datenbank in den USA, die entsprechende Datenbank in der EU; die Datenbank beim deutschen Paul Ehrlich-Institut mit seinem Sicherheitsbericht, oder die offizielle MHRA-Zusammenfassung der Nebenwirkungen des Pfizer/BioNTech-Impfstoffs für Großbritannien, alle weisen eine schauderhafte Bilanz aus.
Die genauen Ursachen für die meisten dieser Nebenwirkungen sind noch unbekannt. Man sollte daher meinen, daß es bei dieser Nachrichtenlage ratsam wäre, daß Studien die Möglichkeiten eines z.B. oxidativen- und anderen Schadens zu untersuchen und ausschließen, bevor die aktuellen speziellen mRNA-Wirkstoffe eingeführt, oder weiter verwendet werden? Dem ist bisher aber nicht so!
Auch im Zulassungsverfahren hakt und klemmt es bei dem Pfizer/BioNTech-Wirkstoff bisher.

Die eigentliche Zulassungsstudie vor der Europäischen Arzneimittelbehörde läuft noch bis 2. Mai 2023. Spätestens dann müssen alle so genannten „Specific Obligations“, also Auflagen, abgeschlossen und erfüllt sein. Bisher ist dies nur bei einer einzigen Auflage, der „SO3“ der Fall. Alle Anderen fünf Auflagen sind bisher trotz Fristsetzung der EMA unerfüllt. Die Gründe, warum diese bisher nicht erfüllt wurden sind unbekannt. Sie reichen rein theoretisch von einer möglichen rein zeitlichen Verfristung bis hin zum Umstand, daß der Wirkstoff Bestandteile enthält, aufgrund derer er gar nicht endgültig zugelassen werden kann.
Die bisherige Anwendung derartiger Gentechnik-Präparate ist nur durch eine Ausnahme von der allgemeinen Gentechnik-Verordnung möglich. Diese gilt aber wiederum nur so lange, wie es einen medizinischen Notfall gibt.
Tatsächlich zeigt die Entwicklung hin zur „Omikron“-Variante, daß diese offenkundig gar nicht mehr gegeben ist. Am heutigen Tag sind im Epizentrum des Ausbruchs der Omikron-Variante in Südafrika von seinen 60 Millionen Einwohnern lediglich 244 mit einem positiven PCR-Test am Beatmungsgerät (Bild rechts). Die davon ausgehende Botschaft ist eigentlich klar: Omikron entlastet das Gesundheitswesen und verleiht eine natürliche Immunität. In Südafrika war Omikron selbst bei seinem schlagartigen Auftraten jedenfalls nicht in der Lage das Gesundheitssystem zu überfordern.
Mit einem „Notfall“ hat dies evidentermaßen rein gar nichts mehr zu tun.
Hinzu kommen die Nebenwirkungen. Von deren Ausmaß zeugen die Datenbanken in aller Welt, in denen diese Nebenwirkungen gesammelt werden.
Doch nicht nur die mRNA-Substanz selbst, sondern auch weitere, im Serum enthaltene Stoffe können Nebenwirkungen auslösen, oder zu Nebenwirkungen beitragen. Dazu gehören auch die in dem verspritzten Serum von BioNTech enthaltenen „kationischen Lipide“:
.
Eine verräterische Streichung auf einer Herstellerwebseite
Am 9.12.2021 um 1Uhr11 GMT in der Früh hatte ein Blog, der sich um Aufklärung über den Umgang mit Covid bemüht, den Beitrag
online gestellt. Darin enthalten war ein Screenshot der Information des Herstellers eines in dem BioNTech-Wirkstoff enthaltenen Zusatzstoffs. Auf der Webseite gibt der Hersteller Echelon Biosiences an, daß der von ihm vertriebene Stoff eben gerade NICHT für den menschlichen Gebrauch bestimmt sei. So kann man der Webseite am 8.12. noch entnehmen konnte:
Diese Aussage ist eigentlich eindeutig. Nicht einmal eine halbe Stunde später, so kann man es dem Eintrag aus dem WebArchive entnehmen, wurde diese Passage einfach gelöscht. Dort steht nun politkorrekt:
Dessen ungeachtet ist dieser Stoff offenbar in dem Serum enthalten, das bald überall per Gesetz „verimpft“ werden soll.
Wer derart schnell löscht und sich nicht erklärt, der hat wohl etwas zu verbergen, könnte man annehmen.
Eine Spurensuche führt tatsächlich zu einem bedenklichen Stoff, der da in dem „beliebten“ BioNTech-Serum mitverspritzt wird,
.
ALC-0315 und ALC-0159?
Die neuartigen und bisher kaum erforschten mRNA-Wirkstoffe werden dem Menschen nicht als reine Wirkstoffe verabreicht, sondern als Gemische verschiedenster Stoffe. Mindestens ein Teil davon ist in den offiziellen Zulassungsunterlagen aufgelistet;
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
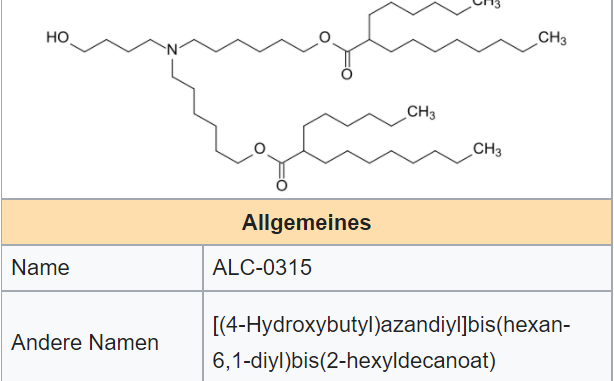
- ((4-Hydroxybutyl)azandiyl)bis(hexan-6,1-diyl)bis(2-hexyldecanoat) (ALC-0315)
- 2-[(Polyethylenglykol)-2000]-N,N-ditetradecylacetamid (ALC-0159)
- Colfoscerilstearat (DSPC)
- Cholesterol
- Kaliumchlorid
- Kaliumdihydrogenphosphat
- Natriumchlorid
- Natriummonohydrogenphosphat Dihydrat
- Sucrose
- Wasser für Injektionszwecke
- Natriumhydroxid (zur pH-Einstellung)
Salzsäure (zur pH-Einstellung)
Daß diese beiden Stoffe ALC-0315 und ALC-159 in den verspritzten Wirkstoffen von BioNTech/Pfizer enthalten sind, gibt die Europäische Arzneimittelbehörde EMA damit selbst zu, ALC-0315 wird darin 10 Mal, ALC-0159 wird darin 11 Mal erwähnt.
Da also die EMA diese Stoffe auflistet, ist es eigentlich unmöglich, daß die EMA für diese Stoffe keine Zulassung erteilt hat, wie manchmal zu lesen ist.
Fakt ist aber wohl auch, daß Pfizer/BioNTech zu dieser endgültigen Zulassung bis Juli 2021 ergänzende Informationen hätte liefern müssen, die betreffend ALC-0315 und ALC-0159 bisher aber noch immer fehlen:
.
Bisher nicht untersuchte Hilfsstoffe?
Pfizer/BioNTech hätte bis Juli 2021 ergänzende Informationen zu liefern gehabt. Doch diese fehlen bisher offenbar noch betreffend der Hilfsstoffe ALC-0159 und ALC-0315, wie man dem EMA Assessment Report für die so genannte „vorläufige Zulassung“ ab Seite 22 entnehmen kann:
Und weiter

Übersetzt bedeutet dies:
Mit anderen Worten: Pfizer/BioNTech hat bisher zu diesen beiden Stoffen nicht genügende Informationen geliefert, daß diese hinreichend geprüft werden konnten. Daher hat die EMA den – wohl vorläufigen – Kunstgriff verwendet, so lange die Wirkung derselben von früheren Anwendungen vorläufig zu übernehmen (vgl. Seite 23).
.
ALC-0315 und ALC-0159 im BioNTech-Pfizer Wirkstoff
Neben der im Labor hergestellten mRNA enthält der den Bürgern injizierte Wirkstoff also auch:
- ALC-0315 = (4-Hydroxybutyl)azandiyl)bis (Hexan-6,1-diyl)bis(2-hexyldecanoat)
- ALC-0159 = 2-[(Polyethylenglykol)-2000]-N,N-ditetradecylacetamid.
Diese Nanopartikel haben im Wirkstoff die Aufgabe, die Aufnahme von therapeutisch wirksamen Nukleinsäuren wie Oligonukleotiden oder mRNA zu fördern und das sowohl in vitro (also im Labor) als auch in vivo (also im beim lebenden Menschen).
Sie wirken hierbei wie folgt: Unterhalb des physiologischen pH-Werts wird ALC-0315 am Stickstoffatom protoniert, wodurch ein Ammonium-Kation entsteht, das von der anionischen Boten-RNA (mRNA) angezogen wird. Mit anderen Worten: Das sind „Fette“, die die mRNA als Hülle umgeben und dafür sorgen, daß die mRNA überhaupt in die menschliche Zelle aufgenommen werden kann. Sie werden benötigt, um die mRNA davor zu bewahren, daß sie selbst durch das Immunsystem vernichtet wird und unterstützen das Eindringen in die Körperzellen. BioNTech, CureVac und Moderna mit diesen Stoffen damit längerer Zeit bei ihren Versuchen, Medikamente gegen Krebs zu entwickeln.
Im Kern handelt es sich hierbei um Nanopartikel.
Das Land Baden-Württemberg hat zu diesen Stoffen folgende Hinweise gegeben:
.
Britischer Gesundheitsdienst warnt Allergiker vor Lebensgefahr bei Aufnahme von ALC-0315 und ALC-0159
Die Formulierung von LNP von Pfizer/BioNTech ist proprietär, Quellen geben jedoch den Anteil des kationischen Lipids ALC-0315 in der Lipidhülle mit ca. 50% an.
Es ist unbekannt, wie viele dieser LNPs pro 30 µg (eine Dosis) injiziert werden, aber dieser Punkt muss untersucht werden.
.
Toxizität von kationischen Lipiden
Diese kationischen Lipide werden seit über 30 Jahren untersucht, seit die kationische Lipid-basierte Genabgabe (Lipofektion) 1987 erstmals von der Felgners Gruppe veröffentlicht wurde, fanden jedoch aufgrund ihrer Toxizität keinen Eingang in die allgemeine Anwendung. Nicht nur Zellbiologen mit Erfahrung auf diesem Gebiet sagen, dass kationische Lipide „sehr, sehr toxisch“ sind.
Ein von Experten begutachteter Artikel in Toxicology Research vom April 2018 stellt im Eröffnungssatz seines Abstracts fest:
Diesen alternativen Weg für eine Nutzung „sichererer und effizienterer kationischer Lipide“ ist Pfizer/BioNTech offenbar bisher nicht in der Lage zu gehen, denn sonst hätten sie ein solches sicheres Verfahren doch genutzt und nicht das in der Studie als „toxisch“ bezeichnete unsichere Verfahren.
.
Analysen der Toxizität dieser Lipide:
Einem Artikel aus dem Mai 2019, „Lipid Nanoparticles for Delivery of Therapeutic RNA Oligonucleotides“, ist hierzu zu entnehmen:
- „A major drawback with the use of cationic lipids for gene delivery is the high net positive charge associated with the headgroup as well as induction of immune response … Furthermore, particles of cationic nature are known to undergo accumulation in the liver, lung, and spleen.“
- „Ein großer Nachteil bei der Verwendung kationischer Lipide für die Genübertragung ist die hohe positive Nettoladung, die mit der Kopfgruppe verbunden ist, sowie die Induktion der Immunantwort … Darüber hinaus ist bekannt, dass sich Partikel kationischer Natur in Leber, Lunge und Milz anreichern.“
Eine detaillierte Analyse der Wirkung von kationischen Lipiden auf Leberzellen kann wiederum einer Studie mit dem Titel “ Metabolomics revealed the toxicity of cationic liposomes in HepG2 cells using UHPLC-Q-TOF/MS and multivariate data analysis“ vom Dezember 2017 entnommen werden, der auch ausführt, warum diese Lipide toxisch wirken können (CLs bedeuten kationische Lipide):
- „Die Pfadanalyse zeigte signifikante Veränderungen der Stoffwechselwege, die den Aminosäurestoffwechsel, den Energiestoffwechsel, den Fettstoffwechsel und den oxidativen Stress in der CLs-Expositionsgruppe im Vergleich zur Kontrollgruppe umfassen. Zu den Metaboliten im Zusammenhang mit den oben genannten Stoffwechselwegen gehörten Phenylalanin, Methionin, Kreatin, Oxalessigsäure, Glutathion, oxidiertes Glutathion, Cholinphosphat und mehrere ungesättigte Fettsäuren, was darauf hindeutet, dass Zellen im Aminosäurestoffwechsel, der Energie- und Lipidversorgung gestört waren, wenn die CLs-Exposition induziert wurde Verletzung aufgetreten. Es wird der Schluss gezogen, dass CLs Zytotoxizität induzieren können, indem sie reaktive Sauerstoffspezies in vitro verstärken, den normalen Prozess des Energiestoffwechsels beeinflussen, mehrere lebenswichtige Signalwege stören und schließlich den Zelltod induzieren.“
Exponentielle Effekte durch mitochondriale Schäden?
.
Erhebliche Marker-Fehlregulation festgestellt
Ungefähr 60 % finden aber ihren Weg in die Leber, wie im EMA-Bericht auf Seite 46 erwähnt:
In einem Tierversuch, der als Nachweis für die Zulassung des Impfstoffs von BioNTech bei der EMA eingereicht wurde, führte dies zu hohen Erhöhungen der Leberenzyme GGT
was auf Leberschäden hinweist, und AST, das bei Leber- und Herzentzündungen ansteigt, sowie (Blatt 50)
Einer weiteren Studie kann man Hinweise zur Toxizität und immunmodulatorischen Aktivität von mit kationischen Lipiden und liposomalen Vektoren gegenüber Immuneffektorzellen entnehmen:
.
Die Warnung der britischen Gesundheitsbehörden
Der britische offizielle Gesundheitsservice NHS warnte ganz daher offiziell vor der Verabreichung dieser ALC-0315 und ALC-0159 bei Allergikern. Unter der Überschrift
„Was Sie wissen müssen, bevor Sie den COVID-19 mRNA Impfstoff BNT 162b2 erhalten„
nimmt der NHS ganz offiziell wie folgt Stellung zu diesen beiden ALC-Wirkstoffen:
What COVID-19 mRNA Vaccine BNT162b2 contains:
After dilution, the vial contains 6 doses, of 0.3 mL with 30 micrograms tozinameran each.
- ALC-0315 = (4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate)
- ALC-0159 = 2[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide
- 1,2-Distearoyl-sn-glycero-3-phosphocholine
- cholesterol
- potassium chloride
- potassium dihydrogen phosphate
- sodium chloride
- disodium hydrogen phosphate dihydrate
- sucrose
- water for injections“
.
Durchgeführte Prüfungen
Ursprünglich wurde von Pfizer/BioNTech das Bild aufgebaut, das Serum verbliebe im Arm:
Dies hat sich für den mRNA-Wirkstoff inzwischen als falsch herausgestellt. Tatsächlich vagabundiert dieser Wirkstoff durch den gesamten Körper. Die Unterlagen der EMA belegen, daß auch die Nanopartikel ALC-0159 und ALC-0315 durch den Körper vagabundieren. Auf Seite 45f der Unterlagen finden sich nämlich folgende Informationen aus der Prüfung der beiden Lipide an Ratten:

Beiden Darstellungen kann man entnehmen, daß sich insbesondere das Lipid ALC-0135 lange im Blut (Bild links) und in der Leber (Bild rechts) hält. Das rechte Bild zeigt, daß ALC 315 in der Leber nur in den ersten 200 Stunden durchgeführt wird. Danach, also ab 200 Stunden ist kein weiterer Abbau in der Leber mehr erkennbar.
.
Die nicht erfüllten Auflagen
 Zum Zweck einer ersten Stellungnahme genügen der Behörde die übergebenen Daten. Nicht aber für eine Dauerzulassung (Seite 36):
Zum Zweck einer ersten Stellungnahme genügen der Behörde die übergebenen Daten. Nicht aber für eine Dauerzulassung (Seite 36):
Und diese sind sicherhietsrelevant
Die dann folgende Liste ist mit fett gekennzeichneten Fristen markiert (Bild rechts).








